制定者:中华医学会神经外科学分会中国神经外科重症管理协作组;
通信作者:
魏俊吉,100730 中国医学科学院北京协和医学院北京协和医院神经外科,Email:weijjl999@163.com。
康德智 ,350005 福建医科大学附属第一医院神经外科,Email:kdz99988@vip.sina.com。
本共识发表在《中华医学杂志》,2018年6月5日第98卷第21期
老龄化社会时代,患有心肌梗死、脑梗死、心房纤颤以及心脏瓣膜疾病等心脑血管疾病的患者越来越多,同时由于现代介入技术的广泛开展,抗栓药物治疗已成为临床的常规治疗方法。抗栓药物治疗过程中颅内出血患者比单纯颅内出血患者预后差,并且病死率和致残率高。
目前,国内对抗栓药物治疗中的颅内出血处置方法相对不规范。主要原因在于:(1) 全药物使用上的矛盾性,继续使用出血风险增加,药物停用或者进行相关的拮抗治疗会导致血栓类4发生率增高。(2) 此类疾病涉及心内科学、血液病学、神经内科学、血管外科学、药理学等多学科专业,单一学科处理此类疾病不够全面。(3) 传统观念认为抗栓药物治疗情况下是手术禁忌。
为提高我国神经外科医生对于此类疾病的认识和管理水平,中国神经外科重症管理协作组召集来自不同机构、不同学科的专家组成编写委员会,编写了《抗栓药物治疗中颅内出血患者神经外科围手术期管理中国专家共识(2018版)》(以下简称本共识)。首先,本共识特指在抗凝及抗血小板治疗期间(尿激酶、链激酶及重组组织型纤溶酶原激活剂等溶栓剂因原发病复杂等因素,本共识不做讨论)发生的蛛网膜下腔出血(外伤性或自发性)、脑实质内出血(外伤性或自发性)、脑室内出血、硬膜下血肿、硬膜外血肿和脑挫裂伤;其次,本共识手术适应征特指根据国内外文献及指南,已经具备神经外科相对手术适应证的颅内出血患者,手术适应证本共识不再赘述。
共识参考了国内、外相关领域最新的指南、共识、临床试验、前瞻性和回顾性临床研究等制定。同时也特别指出,本专家共识有助于临床决策,但不能替代具体情况下的个体化治疗,更不能作为法律依据。
一、抗凝药物治疗中的颅内出血
抗凝药物经常用于房颤、人工机械瓣膜置换术后、外周静脉血栓以及肺栓塞患者。有文献报道抗凝药物治疗过程中自发性脑出血发生率倍数增加,12%~14%脑实质出血与抗凝药物相关,0.3%~1.1%接受维生素K拮抗剂(VKA)治疗的患者会发生脑实质出血。抗凝药物相关性脑出血预后极差,90%的VKA相关性死亡是脑实质出血,VKA相关脑实质出血的死亡率、神经功能和预后均比非凝血功能障碍脑出血要差,致死率和致残率较高的原因包括血肿体积更大,再出血风险更高,其他相关并发症更多。
快速逆转凝血功能是治疗VKA相关脑出血的关键,对于凝血功能的纠正可以改善预后,降低死亡率,阻止血肿增大。抗凝药物使用时的颅内出血,72h内血肿都有可能增大。部分神经功能完好、血肿小、国际标准化比值(INR)<2.0的患者,保守治疗是可行的,尽管这部分患者是否能从纠正凝血功能障碍中获益还存在争议。对于脑出血合并颅内静脉窦血栓的患者,一般情况下推荐持续抗凝治疗。此外,如果脑出血患者合并危及生命的缺血、血栓、弥漫性血管内凝血(DIC)时,纠正凝血功能时需谨慎 。
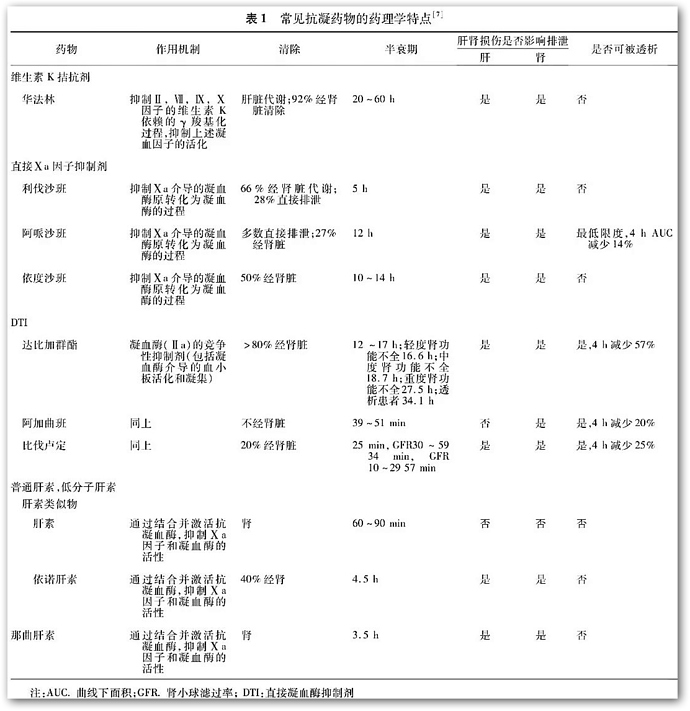
1、抗凝药物的分类及作用机制(表1):
(1)VKA:
包括华法林,醋硝香豆素,苯丙香豆素,双香豆素等。VKA通过抑制维生素K,进而抑制维生K依赖性凝血因子ⅡⅦⅨⅩ在肝脏的合成,从而发挥抗凝作用。但VKA对已经合成的上述凝血因子在体内相对耗竭后,VKA才能发挥抗凝效应。所以,VKA起效相对缓慢,停药后药效持续时间较长(直到维生素K依赖性凝血因子恢复到一定浓度后,抗凝作用才消失)。VKA也抑制具有抗凝作用的蛋白S和蛋白C在肝脏的合成。由于已合成的蛋白S和蛋白C在体内的消耗速度较快,VKA在用药早期有可能产生促凝作用。许多药物可以实现对于VKA药物的纠正,包括口服或静脉应用维生素K,新鲜冰冻血浆(FFP),凝血酶原复合物(PCC),重组的活化Ⅶa因子(rFⅦa)。这些药物在恢复INR的效率、速度及安全性方面各不相同。
(2)直接Xa因子抑制剂:
利伐沙班、阿哌沙班、依杜沙班是临床上常用的3种口服的直接Ⅹa因子抑制剂。通过抑制Ⅹa因子阻止凝血酶原转变为凝血酶,从而发挥抗凝作用。适应症包括非瓣膜性房颤患者的卒中预防,以及深静脉血栓、肺栓塞的预防和治疗。
(3)直接凝血酶抑制剂(DTI):
DTI包括达比加群(口服)、比伐卢定(仅静脉)、地西卢定(皮下)、阿加曲班(仅静脉)和重组水蛭素(仅静脉)。DTI通过抑制凝血酶,阻止纤维蛋白原裂解为纤维蛋白,从而阻断了凝血瀑布的最后步骤以及血栓的形成。适应症包括非瓣膜性房颤患者的脑卒中预防,以及深静脉血栓、肺栓塞的预防和治疗;比伐卢定被推荐用于合并肝素诱导的血小板减少症的急性冠脉综合征患者和经皮冠状动脉介入患者的抗凝治疗。
(4) 普通肝素:
是注射用抗凝药物。肝素与抗凝血酶结合后,通过抗凝血酶间接抑制Xa和Ⅱa因子的活性,从而发挥抗凝作用。
(5)低分子肝素(LMWH):
是普通肝素的裂解产物,也是一种注射用抗凝药物。LMWH与抗凝血酶结合后,通过抗凝血酶间接抑制凝血因子Xa和Ⅱa因子的活性,从而发挥抗凝作用。与普通肝素相比,低分子肝素具备更可预测的药物代谢动力学特征和生物利用度;而且,经皮下注射给药,使用更为方便。
2、术前抗凝药物的拮抗方案:
(1)VKA:
-
① 使用INR监测凝血功能,术前纠正INR至<1.4。
② 当出现或怀疑颅内出血时,停用VKA,同时应该拮抗VKA的作用,以下两种情况除外:A.高度怀疑因颅内静脉窦血栓导致的颅内出血,不建议拮抗VKA;B.当脑出血患者同时合并有症状的或危及生命的血栓形成、缺血、肝素介导血小板减少,或DIC时,要在充分评估风险和获益后再决定是否拮抗VKA。
③ 对于VKA相关脑出血患者尽快给予维生素K。推荐单剂量10mg维生素K静脉注射。随后的治疗要根据复查的INR结果决定。如果在给予VKA拮抗剂的24〜48h内,INR依然>1.4,建议再次给予维生素K10mg静脉注射。
④ 对于INR〉1.4的VKA相关性脑出血患者,推荐给予含3种或4种因子的凝血酶原复合物(PCC)。新鲜冰冻血浆(FFP)也可以作为次选的拮抗剂。推荐按体质量给予PCC,并根据入院时的INR水平和PCC种类加以调整。给予PCC15〜60min后复查INR,在随后的24〜48h,每6~8小时复查1次INR。后续治疗需要根据复查的INR水平决定。再次给予PCC可能增加血栓相关并发症发生率和DIC的风险,因此不推荐重复给予PCC。如果给予PCC后24〜48h复查INR仍然>1.4,建议给予FFP继续纠正INR。
⑤ 如果无法获得PCC或有使用PCC的禁忌,推荐给予FFP联合维生素K治疗。在给予单剂量10mg维生素K静脉注射后,按10〜15ml/kg给予静脉输注FFP。
(2)直接Xa因子抑制剂:
-
① 当发生颅内出血或者怀疑颅内出血时,建议停用直接Xa因子抑制剂。
② 建议记录应用直接Xa因子抑制剂的时间信息和可能的药物相互作用,以帮助评估抗凝剂的暴露程度。
③ 如果使用直接Xa因子抑制剂在2h内,对已经进行气管插管或气道阻塞风险小的颅内出血患者应用活性炭(50g)。
④ 对于仍在药物3~5个半衰期内的颅内出血患者,建议使用PCC(50U/kg)。如果患者肝功能不全,即使停药时间>3〜5个药物半衰期,仍需给予拮抗治疗。
⑤ 目前尚有效的实验室指标监测直接Xa因子抑制剂对凝血功能的抑制作用。
(3)DT I:
-
①在出现或怀疑颅内出血时停用直接凝血酶抑制剂。
② 评估末次给药的时间、剂量、肾功能和可能的药物相互作用,以帮助判断抗凝作用的暴露强度。
③ 在有胃肠道置管和(或)低误吸风险的颅内出血患者中,在口服直接凝血酶抑制剂2h之内使用活性炭(50g)。
④ 使用特异性拮抗剂(Idarucizumab)对达比加群的抗凝作用进行逆转。但Idarucizumal)目前在我国尚未上市。
⑤ 无法获得Idarucizumab或者发生其他DTI相关的顾内出血时,可应用PCC(50U/kg)。
⑥ 在合并肾功能不全的达比加群相关颅内出血患者或达比加群过量的患者中,如果无法获得依达赛珠单抗,推荐进行血液透析。
⑦ 若经过Idarucizumab、PCC治疗,患者仍有严重持续性颅内出血,建议再次使用依达赛珠单抗和(或)血液透析。
⑧ 不推荐在直接凝血酶抑制剂相关的颅内出血患者中使用rFⅦa或FFP
⑨ 目前尚无有效的实验室指标可以监测直接凝血酶抑制对凝血功能的抑制作用。
(4) 普通肝素:
-
① 当出现或怀疑颅内出血吋建议停用肝素。
② 颅内出血的患者应紧急使用桔抗药物。
③ 不建议对常规预防性皮下注射肝素的患者进行拮抗治疗。仅对预防性皮下注射肝素导致活化部分凝血活酶时间(APTT)显著延长的患者进行拮抗治疗。
④ 対顾内出血的患者建议静脉使用硫酸鱼精蛋白拮抗肝素,每100U肝素用药后2~3h使用1mg硫酸鱼精蛋白,每次浓度不超过50mg,对APTT持续延长的患者,建议对每100U普通肝素重复使用0.5mg鱼精蛋白。
(5) LMWH:
-
① 在出现或怀疑发生颅内出血时,应终止LMWH的使用。
② 接受治疗剂景LMWH的患者发生颅内出血时建议对LMWH的抗凝作用进行拮抗。
③ 建议根据以下配量于10min内静脉缓慢注射鱼精蛋白:A.依诺肝素:依诺肝素使用8h之内,每1mg依诺肝素使用1mg鱼精蛋白(最多不超过50mg)。依诺肝素使用8~12h之间,每1mg依诺肝素使用0.5mg鱼精蛋白。依诺肝素3~5h的半衰期过去后,可能无需使用鱼精蛋白。B.达那肝素及那曲肝素:对每100U抗Xa因子LMWH达3~5h的半衰期后使用1mg鱼精蛋白(最多不超过50mg)。C.对发生严重危及生命的大出血或患有肾功能衰竭的患者,建议减少鱼精蛋白的用量(每100U抗Xa因子LMWH或每1mg依诺肝素使用0.5mg鱼精蛋白)。
④ 对使用鱼精蛋白存在禁忌的患者,可以考虑使用rFⅦa(90μg/kg)。
⑤ 当接受预防剂量LMWH的患者出现颅内出血时,建议停药,但无须进行拮抗治疗。
⑥ 不建议使用鱼精蛋白拮抗达那肝素。
⑦ 建议对达那肝素诱导颅内出血的患者单次使用rFⅦa(90μg/kg)进行拮抗。
⑧ 不建议使用FFP、PCC或活化凝血酶原复合物(aPCC)拮抗LMWH的抗凝作用。
3、神经外科手术原则:
神经外科手术的干预应该在上述指标调整到相对安全的情况下实施。针对已经出现中线移位,脑疝前期甚至脑疝等严重颅内压升高的急性期患者,建议在清除颅内出血的同时,考虑去骨瓣减压;对于中线结构正常的颅内出血或者慢性硬膜下血肿如需要手术治疗,优先推荐进行微创手术治疗。术后应该进行出凝血功能的动态监测。
4、恢复抗凝治疗时机:
对于脑出血后恢复抗凝治疗的最佳时机,目前尚无临床试验进行研究,故缺乏高级别的循证医学证据。只有一些回顾性研究报道了停用抗凝药物后血栓事件的发生率和恢复抗凝治疗后脑出血的发生率。基于有限的循证医学证据,本共识建议:
(1) 对于抗凝适应证为房颤、深静脉血栓的患者,为预防再次出现脑出血,建议术后4周之后再考虑恢复术前抗凝药物。
(2) 对于抗凝适应证为人工机械性瓣膜置换术后的患者、肺动脉栓塞的患者,因其是发生血栓栓塞事件的高危因素,可考虑术于后2周恢复术前的抗凝药物,但需反复交代、充分告知再次发生脑出血的风险较高。
应该强调,颅内出血合并抗凝治疗的患者往往病情复杂多变,如何恢复抗凝并保障多脏器的结构和功能的协调要具体问题具体分析,一定进行多学科协作基础上的个体化治疗。
二、抗血小板治疗并发的颅内出血
1、常见抗血小板药物的分类及作用机制:
目前使用抗血小板药物的人群主要包括:因动脉粥样硬化血栓疾病(冠状动脉疾病、脑动脉疾病、周围动脉疾病等)进行一级预防和二级预防的患者,动脉支架置入术后患者等。临床多为单一药物使用或联合两种药物使用,常见的口服抗血小板药物见表2。
*表2 常见抗血小板药物的药理学特点
| 药物 | 作用机制 | 淸除方式 | 半衰期 | 影响肾 | 影响肝 | 透析清除 |
|---|---|---|---|---|---|---|
| 阿司匹林 | 不可逆性环氧化酶-1和(或)2抑制剂 | 5.6%~35.6%肾代谢 | 20min | 是 | 是 | 是 |
| 双嘧达莫 | 可逆性腺苷再摄取抑制剂 | 粪便代谢 | 10h | 否 | 是 | 否 |
| 氯毗格雷 | 不可逆性ADPP2Y12受体抑制剂 | 50%肾代谢、46%粪便代谢 | 6~8h | 是 | 是 | 否 |
| 噻氯匹定 | 不可逆性ADPP2Y12受体抑制剂 | 60%肾代谢、23%粪便代谢 | 12h | 是 | 是 | 否 |
| 替格瑞洛 | 可逆性ADPP2Y12受体抑制剂 | 26%肾代谢、58%粪便代谢 | 7h,代谢物9h | 否 | 是 | 否 |
| 西洛他唑 | 可逆性磷酸二酯酶(PDE)Ⅲ抑制剂,增加cAMP,抑制ADP诱导致的血小板聚集,引起血管舒张 | 74%肾代谢、20%粪便代谢 | 10h | 是 | 是 | 否 |
2、术前抗血小板药物的替代方案:
目前对于抗血小板药物是否会增加脑出血的发生率,导致血肿增大及影响神经功能预后尚存在争议。文献报道,使用抗血小板药物的患者其脑出血发生率将增加5倍,一旦发生脑出血其3个月死亡率至少增加1倍。但也有报道称抗血小板药物并未对脑出血患者的预后造成影响。由于目前尚缺乏高级别循证医学证据,并不强烈推荐对脑出血患者的血小板功能常规进行纠正。对于有急诊手术需求或血肿处于进展期的患者,建议可以进行新鲜血小板的替代治疗。
对于可逆性抗血小板药物,停药3〜5个半衰期后血小板功能即可恢复。对于不可逆性抗血小板药物,需待新生血小板生成并进人外周血中后,血小板功能才能恢复。因血小板的平均寿命为8〜20d,因此血小板功能将长期受抑制。对于患者血小板功能的评估,除了检测血小板计数外,还可使用光学比浊法、电极阻抗聚集度测定法、血栓弹力图检测法等。上述检测尚只限于检测环氧化酶抑制剂或二磷酸腺苷受体拮抗剂的抗血小板效果。另外,即使存在血小板聚集率低下,也并不代表一定会导致血肿增大或术中出血增加,因此还需要根据临床情况决定是否给予替代治疗。
抗血小板药物的常用替代及纠正方案包括:
-
(1)一般情况下,输注血小板可以改善血小板的功能。但对于脑出血患者而言,输注血小板是否可以避免血肿增大、减少病死率、改善患者预后,目前尚无统一结论。一项最新的多中心、随机、对照试验(PATCH)认为输注血小板不能避免血肿增大和改善预后。该研究结论基于如下几点:
-
①增加了血栓形成事件的发生;
-
② 导致一些促炎症反应;
-
③ 抑制了自身新生血小板的生成;
-
④ 输注血小板的量不足以对抗残存抗血小板药物的抗血小板作用。
-
因此,对于不进行神经外科手术的抗血小板药物相关颅内出血患者,不建议输注血小板。
-
-
(2) 对于阿司匹林/ADP受体抑制剂相关的颅内出血患者,如果行神经外科手术,则建议输注血小板。
- ①建议在输注血小板前进行血小板抑制率的功能测定。
- ②当不能进行血小板功能测定时,可经验性输注血小板。
- ③在实验室证实血小板功能处于正常范围或抗血小板药物抵抗时,不建议输注血小板。
-
(3)对于需要输注血小板的患者,建议初始剂量为1U。在重复输注血小板之前,建议进行血栓弹力图的血小板功能检测,只对持续性血小板功能异常和(或)持续性出血的患者重复输注血小板。
-
(4)对于需要进行神经外科手术的阿司匹林/环氧化酶-1抑制剂或二磷酸腺苷受体抑制剂相关的颅内出血患者,除输注血小板外,还可以使用去氨加压素(DDAVP),推荐单剂量DDAVP治疗(0.4μg/kg静脉注射)。
3、神经外科手术原则:
神经外科手术的干预应该在上述指标调整到相对安全的情况下实施。针对已经出现严重中线移位,脑疝前期甚至脑疝等严重颅内压升高的急性期患者,建议在清除颅内出血的同时,考虑去骨瓣减压;对于中线结构正常的颅内出血或者慢性硬膜下血肿如需要手术治疗,优先推荐进行微创手术治疗。术前、术中一般均需要输注血小板。术后建议继续监测血小板功能,对于持续血小板功能异常和(或)持续出血的患者建议重复输注血小板。
4、恢复抗血小板治疗的时机:
-
(1) 对于冠状动脉支架置入术后患者,若脑出血发生于支架置入术后6个月内,抗血小板药物对于预防支架血栓形成至关重要,故当影像学检查确定无血肿增大后应尽早恢复抗血小板治疗,建议最晚不要超过1周,同时向家属充分告知再出血风险。若脑出血发生于支架置入术后6个月以上,则恢复抗血小板药物时间可适当向后推迟,最晚可推迟至2周。
-
(2) 对于进行动脉粥样硬化血栓疾病一级预防的患者,停用抗血小板药物并不明显增加缺血性卒中风险,可推迟至出血后2周再恢复用药。
-
(3) 对于预防外周动脉血栓的患者,停用抗血小板药物后即使疾病进展亦无生命危险,可推迟至出血后2周再恢复用药。
-
(4) 对于发生深静脉血栓的高危患者,常规推荐使用抗凝药物进行预防,不推荐给予抗血小板药物进行预防。
-
以上内容目前尚无高级别循证医学证据支持;因此,以上研究结果及结论供参考。抗血小板治疗的恢复要根据患者具体病情,在多学科讨论的基础上进行个体化治疗。
随着抗栓药物的广泛应用,合并高危出血因素的颅内出血患者占颅内出血的比例将越来越高。对于这类特殊类型颅内出血的管理水平将决定患者的整体预后。临床治疗此类患者不仅需要丰富的跨学科知识和临床经验,还需要加强多学科协作,更要关注国内外相关领域高级别循证医学证据的更新。未来对新型抗凝药物拮抗的研究以及颅内出血术后恢复抗栓药物治疗时机的相关前瞻性临床研究,将会对提高患者的预后提供更加确切的依据。
本共识编写委员会名单:
周定标(解放军总医院神经外科)、周良辅(复旦大学附属华山医院神经外科)、张建宁(天津医科大学总医院神经外科)、王硕(首都医科大学附属北京天坛医院神经外科)、王任直(中国医学科学院北京协和医学院北京协和医院神经外科)、康德智(福建医科大学附属第一医院神经外科)、胡錦(复旦大学附属华山医院神经外科)、费舟(解放军空军军医大学附属西京医院神经外科)、李新钢(山东大学齐鲁医院神经外科)、赵元立(首都医科大学附属北京天坛医院神经外科)、冯华(解放军陆军军医大学西南医院神经外科)、刘健(贵阳医学院附属医院神经外科)、江基尧(上海交通大学附属上海仁济医院神经外科)、袁贤瑞(中南大学附属湘雅医院神经外科)、高国栋(解放军空军军医大学唐都医院神经外科)、游潮(四川大学附属华西医院神经外科)、漆松涛(南方医科大学南方医院神经外科)、赵世光(哈尔滨医科大学第一附属医院神经外科)、彭斌(中国医学科学院北京协和医学院北京协和医院神经内科)、任祖渊(中国医学科学院北京协和医学院北京协和医院神经外科)、王宁(首都医科大学附属宣武医院神经外科)、田恒力(上海市第六人民医院神经外科)
本共识执笔者名单:
魏俊吉(中国医学科学院北京协和医学院北京协和医院神经外科)、吴昊(中国医学科学院北京协和医学院北京协和医院神经外科)、刘震宇(中国医学科学院北京协和医学院北京协和医院心脏内科)、朱铁楠(中国医学科学院北京协和医学院北京协和医院血液内科)、江荣才(天津医科大学总医院神经外科)、徐峤跃(首都医科大学附属宣武医院神经外科)、柴文昭(中国医学科学院北京协和援学院北京协和医院ICU)、高亮(同济医科大学附属上海第十人民医院)、杨朝华(四川大学附属华西医院神经外科)、芮曦(中国医学科学院北京协和医学院北京协和医院ICU)、胡小芸(中国医学科学院北京协和医学院北京协和医院MICU)、邱炳辉(南方医科大学南方医院神经外科)、李立宏(解放军空军军医大学附属唐都医院神经外科)、李雪元(郑州大学第一附属医院神经外科)、王秀英(解放军总医院神经外科)、吴雪海(复旦太学附属华山医院神经外科)、高国一(上海交通大学附属仁济医院神经外科)、黄齐兵(山东大学齐鲁医院神经外科)、石广志(首都医科大学附属北京天坛医院ICU)、徐珑(首都医科大学附属北京天坛医院神经外科)、林元相(福建医科大学附属第一医院神经外科)、牛焕江(浙江大学附属邵逸夫医院神经外科)、李兵(解放军空军军医大学附属西京医院神经外科)、包义君(中国医科大学第一附属医院神经外科)、汪永新(新疆医科大学第一附属医院神经外科)