[1]Fearon KC,Ljungqvist O,Von Meyenfeldt M,etal.Enhanced recovery after surgery;a consensus review of clinical care for patientsundergoing colonic resection「J].Clin Nutr, 2005,24(3) ;466477. D01;10. 1016/j. clnu.2005.02.002.
[2]Dangayach NS, Caridi J,Bederson J,et alEnhanced Recovery After Neurosurgery:Paradigm Shift andCall to Arms[J].World Neurosurg, 2017,100:683-685.D0I:10.1016/j.wneu.2017.02.1o1.
[3]王勇杰,张建民.药物相关性卒中及其防治策略[J].浙江大学学报(医学版),2015,44(4);361-365. D01.10.3785/j.issn.1008-9292.2015.07.02.
查看更多内容
[4]Chimowitz Ml, Lynn MJ,Howlett-SmithH,et al. Comparison of warfarin and aspirin for symptomatic intracranialarterial stenosis [J].N Engl J Med,2005,352(13):1305-1316.D0I.10.1056/NEJMoa043033.
[5]Saloheimo P,Ahonen M,Juvela S,etal.Regular aspirin-use preceding the onset of primary intracerebral hemorrhage is an independentpredictor for deat [J].Stroke,2006,37(1):129-133. DOI:10.1161/O1.STR.0000196991.03618.31.
[6]Steinberg BA. Non-vitamin-K oralanticoagulants reduce mortality, stroke and intracranial haemorrhage when compared with warfarin in randomised trialsof patients with non-valvular atrial fibrillation[J].Evid Based Med, 2014,19(5) ;182. DOI:10.1136/ebmed-2014-110004.
[7]Campbell PG, Sen A,Yadla S,etal.Emergency reversal of antiplatelet agents in patients presenting with an intracranial hemorrhage;a clinicalreview[J].World Neurosurg, 2010,74 ( 2-3);279-285. D0I.10.1016/j.wneu.2010.05.030.
[8]Lee AT,Gagnidze A,Pan SR,etal.Preoperative low-dose aspirin exposure and outcomes after emergency neurosurgeryfor traumatic intracranial hemorrhage in elderly patients[J].Anesth Analg,2017,125(2):514-520.D0I.10.1213/ANE.0000000000002053.
[9]Douketis JD.Perioperative management ofpatients receiving anticoagulant or antiplatelet therapy;a clinician-orientedand practical approach[J].Hosp Pract,2011,39(4);41-54. D0I:10.3810/hp.2011.10.921.
[10]Menzin J,Sussman M,Nichols C,et al.Use ofblood products in patients with anticoagulant-related major bleeding;an analysisof inhospital outcomes[J].Am J Health Syst Pharm, 2014,71(19):1635-1645.D0I:10.2146/ajhp130729.
[11]Frontera JA, Lewin JJ 3rd, RabinsteinAA,et al.Guideline for reversal of antithrombotics in intracranialhemorrhage; a statement for healthcare professionals from the NeurocriticalCare Society and Society of Critical Care Medicine[J].Neurocrit Care, 2016,24(1):6-46.D0I.10.1007/s12028-015-0222-x
[12]Veltkamp R, Horstmann S. Treatment ofintracerebral hemorrhage associated with new oral anticoagulant use;theneurologist’s view [J].Clin Lab Med, 2014,34(3):587-594.DOI:10.1016/j.c11.2014.06.007.
[13]Hogg PJ,Jackson CM.Fibrinmonomer protects thrombin from inactivation by heparin-antithrombin Ⅲ:Implicationsfor heparin efficacy[J].Proc Natl Acad Sci USA,1989,86(10):3619-3623.
[14]Schramm B,Leslie K,Myles PS,etal.Coagulation studies in preoperative neurosurgical patients[J].AnaesthIntensive Care,2001,29(4) ;388-392.
[15]神经外科围手术期出血防治的专家共识[J].中华医学杂志,2010,90(15):1011-1014.D0I:10.3760/cma.j.issn.0376-2491.2010.15.002.
[16]考杉斯基主编,陈竺等译.威廉姆斯血液学[M].第8版.北京:人民卫生出版社,2011;1751-1754.
[17]Chee YL,Crawford JC,Watson HG,etal.Guidelines on the assessment of bleeding risk prior to surgery or invasiveprocedures.British Committee for Standards in Haematology[J].Br J Haematol,2008,140(5):496-504.DOI:10. 1111/j.1365-2141.2007.06968.x
[18]许盛松,张俊峰.常用血小板功能检测方法研究进展[J].医学综述,2016,22(15);3003-3006. D0I:10.3969/j.issn.1006-2084.2016.15.027.
[19]E1 Kady N,Khedr H,Yosry M,etal.Perioperative assessment of coagulation in paediatric neurosur}ical patientsusing thromboelastography[J].Eur J Anaesthesiol, 2009,26(4);293-297. DOI:10.1097/EJA.Ob013e32831c8b5f
[20]Neyens R,Bohm N,Cearley M,etal.Dabigatran-associated subdural hemorrhage:usingthromboelastography(TEG®)to guide decision-making[J].J Thromb Thrombolysis,2014,37 (2):80-83. D0I:10.1007/s11239-013-0933-9.
[21]Masova L,Rysava J,KrizovaP’,et al.Hemostyptic effect of oxidized cellulose on blood platelets[J].Sb Lek,2003,104 (2):231-236.
[22]Voormolen JH,Ringers J,Bots GT,etal.Hemostatic agents;brain tissue reaction and effectiveness. A comparative animal studyusing collagen fleece and oxidized cellulose[J].Neurosurgery, 1987,20(5):702-709.
[23]Spotnitz WD,BurksS.Hemostats,sealants,and adhesives:components of thesurgical toolbox「J].Transfusion, 2008,48(7):1502-1516. DOI:10.1111/j.1537-2995.2008.01703.x.
[24]Light RU,Prentice HR.Surgicalinvestigation of a new absorbable sponge derived from gelatin for use inhemostasis[J].J Neurosurgery,1945,2:435-445.
[25]Gazzeri R,Galarza M,AlfierA.Safety biocompatibility of gelatin hemostatic matrⅨ(Floseal andSurgiflo)in neurosurgical procedures[J].Surg Technol Int,2012,22:49-54.
[26]Fiss I,Danne M,StendelR.Use of gelatin-thrombin matrⅨ hemostatic sealant in cranial neurosurgery[J].Neurol Med Chir,2007,47(10):462-467.
[27]Spotnitz WD.Hemostats,sealants,andadhesives:a practical guide for the surgeon[J].Am Surg,2012,78(12):1305-1321.
[28]Neveleff DJ. Optimizing hemostaticpractices:matching the appropriate hemostat to the clinical situation[J].AORNJ,2012,96(5):SI-S17.D0I:10.1016/j.aorn.2012.08.005.
[29]Jackson MR.Fibrin sealants in surgicalpractice:an overview [J].Am J Surg,2001,182(2 Suppl):1S-7S.
[30]Mankad PS,Codispoti M.The role offibrin sealants in hemostasis[J].Am J Surg,2001,182(2 Suppl):21S-28S.
[31]Green AL,Arnaud A,Batiller J,et al.Amulticentre,prospective, randomized, controlled study to evaluate the use of afibrin sealant as an adjunct to sutured ducal repair[J] .Br J Neurosurg, 2014,12:1-7.DOI:10.3109/02688697.2014.948808.
[32]Kassam A,Horowitz M,Carrau R,etal.Use of Tisseel fibrin sealant in neurosurgical procedures:incidence ofcerebrospinal fluid leaks and cost-benefit analysis in a retrospective study[J]. Neurosurgery,2003,52(5):1102-1105.
[33]Tan TC,Black PM.Sir VictorHorsley(1857-1916):pioneer of neurological surgery[J].Neurosurgery, 2002,50(3):607-611.
[34]Notarnicola A,Moretti L,Martucci A,etal.Comparative efficacy of different doses of fibrin sealant to reduce bleedingafter total knee arthroplasty[J].Blood Coagul Fibrinolysis,2012,23(4):278-284.DOI:10.1097/MBC.Ob013e3283518846.
[35]Dancey AL,Cheema M,Thomas SS.Aprospective randomized trial of the efficacy of marginal quilting sutures andfibrin sealant in reducing the incidence of seromas in the extended latissimusdorsi donor site[J].Plant Reconstr Surg, 2010,125(5):1309-1317.DOI:10.1097/PRS.Ob013e3181d4fb68.
[36]Kluba T,Fiedler K,Kunze B,et al.Fibrinsealants in rthopaedic surgery:practical experiencesderived from use of QUⅨIL® in total knee arthroplasty[J].Arch Orthop Trauma Surg,2012,132(8):1147-1152.D0I:10.1007/s00402-012-1519-2.
[37]Martyn D,Kocharian R, Lim S, etal.Reduction in hospital costs and resource consumption associated with the useof dvanced topical hemostats during inpatient procedures[J].J Med Econ,2015,18(6):474-481.D0I:10.3111/13696998.2015.1017503.
[38]王睿,方翼,裴斐,等.单剂静注尖吻蝮蛇血凝酶在中国健康志愿者的药代动力学[J].中国临床药理学杂志,2006,22(6):422-425.
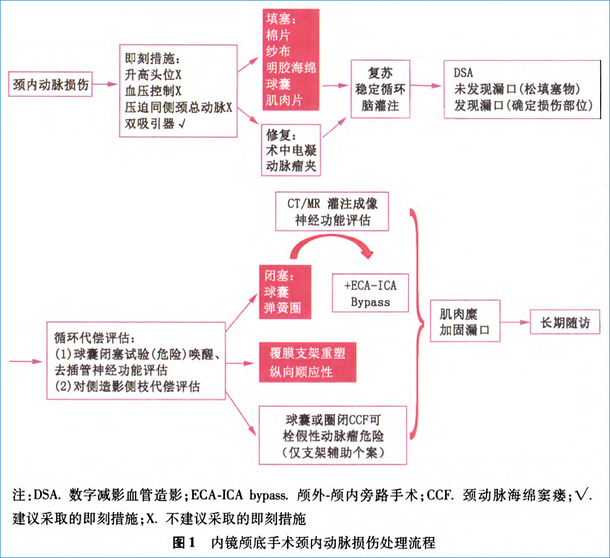
[39]张亚卓.内镜神经外科学(第2版)[M].北京:人民卫生出版社,2017:240-247.
[40]Sylvester PT,Moran CJ,DerdeynCP,et al.Endovascular management of internal carotid artery injuries secondary toendonasal surgery:case series and review of the literature[J].J Neurosurg,2016,125(5):1256-1276.D0I:10.3171/2015.6.JNS142483.
[41]Romero ADCB,LalGangadharan J,Bander ED,et al.Managing Arterial lnjury in Endoscopic Skull BaseSurgery;Case Series and Review of the Literature[J].Oper Neurosurg,2017,13(1): 138-149.DOI:10.1227/NLU.0000000000001180.
[42]Gardner PA,Tormenti MJ,Pant H,etal.Carotid artery injury duringendoscopic endonasal skull base surgery:incidence andoutcomes[J].Neurosurgery,2013,73(2 Suppl Operative): ons261-269. DOI:10.1227/01.neu.0000430821.71267.f2.
[43]Kassam AB,Prevedello DM,Carrau RL,etal. Endoscopic endonasal skull base surgery:analysis of complications in the authors’initial 800 patients[J].JNeurosurg,2011,114(6):1544-1568.DOI:10.3171/2010.10.JNS09406.
[44]A1Qahtani A,Castelnuovo P, Nicolai P,etal.Injury of the internal carotid artey during endoscopic skull base surgery:preventionand management protocol[J].Otolaryngol Clin North Am,2016,49(1):237-252.D0I:10.1016/j.otc.2015.09.009.
[45]Barboza MA,Chang J,HernandezA,et al.Safety of Dual Antiplatelet Therapy After Carotid Endarterectomy forPrevention of Restenosis:A Single Center Experience[J].J Vasc Interv Neurol,2016,9(2):5-9.
[46]ILLuminati G,SchneiderF,Pizzardi G,et al.Dual antiplatelet therapy does not increase the risk ofbleeding after carotid endarterectomy :results of aprospective study[J].Ann Vasc Surg, 2017,40:39-43. D0I:10.1016/j.avsg.2016.09.012.
[47]Pavne DA,Jones CI,Hayes PD,et al.Beneficial effects of clopidogrel combined with aspirin in reducingcerebral emboli in patients undergoing carotid endarterectomy[J].Circulation,2004,109(12):1476-1481.D0I:10.1161/01.CIR0000121739.05643.E6.
[48]Vogten JM,Gerritsen WB,AckerstaffRG,et al.Perioperative microemboli and platelet aggregation in patientsundergoing carotid endarterectomy[J].Vascular,2008,16(3):154-160.D0I:10. 2310/6670.2008.00027.
[49]Payne DA,Jones CI,Haves PD,etal.Platelet inhibition by aspirin is diminished in patients during carotidsurgery:a form of transient aspirinresistance?[J].Thromb Haemost,2004,92(1);89-96.D01:10.1160/TH1103-12-0758.
[50]Webster SE,Payne DA,Jones CI, et al.Anti-platelet effect of aspirin is substantially reduced afteradministration of heparin during carotidendarterectomy[J].J Vasc Surg,2004,40(3): 463-468.D0I:10.1016/j.jvs.2004.06.022.
[51]Morales Gisbert SM,SalaAlmonacil VA,Zaragoza Garcia JM,et al.Predictors of cervicalbleeding after carotid endarterectomy [J].Ann Vasc Surg,2014,28(2):366-374.D0I:10.1016/j.avsg.2013.04.011.
[52]Jones DW,Goodney PP,ConradMF,et al.Dual antiplatelet therapy reduces stroke but increases bleeding at thetime of carotid endarterectomy[J].J Vasc Surg,2016,63(5):1262-1270.e3.D0I:10.1016/jvs.2015.12.020.
[53]Guo J,Gu Y,Guo L,etal.Effects of sarpogrelate combined with aspirin in patients undergoing carotidendarterectomy in China:a single-center retrospective study[J].Ann Vasc Surg,2016,35:183-188.D0I:10.1016/j.avsg.2016.01.032.
[54]Newhall KA,Saunders EC,Larson RJ,et al.Use ofprotamine for anticoagulation during carotid endarterectomy:ameta-analysis[J].JAMA,2016,151(3):247-255。D0I:10.1001/jamasurg.2015.3592.
[55]Patel RB,Beaulieu P,Homa K,etal.Shared quality data are associated with increased protamine use and reduced bleedingcomplications after carotid endarterectomy in the Vascular Study Group of New England[J].J Vasc Surg,2013,58(6):1518-1524.e1.D0I:10.1016/j.jvs.2013.06.064.
[56]Stone DH,Nolan BW,SchanzerA,et al.Protamine reduces bleedingcomplications associated with carotid endarterectomy without increasing the risk of stroke[J].JVasc Surg,2010,51(3): 559-564,564.e1.D0I:10.1016/j.jvs.2009.10.078.
[57]Lynch NP,Kavanagh EG.Does routinereversal of heparin with protamine sulphate in patients undergoing carotidendarterectomy reduce bleeding complications without leading to increasedthromboembolic complications?[J].Eur J Vasc Endovasc Surg, 2016,51(1):150.D0I:10.1016/j.ejvs.2015.09.001.
[58]McMahon GS,Webster SE,Hayes PD,etal.Low molecular weight heparinsignificantly reduces embolisation after carotid endarterectomy–a randomisedcontrolled trial[J].Eur J Vasc Endovasc Surg,2009,37(6):633-639.D0I:10.1016/j.ejvs2009.02.009.
[59]Bowden D,Hayes N,London N,etal.Carotid endarterectomy performed in the morning is associated with increasedcerebral microembolization[J].J Vasc Surg,2009,50(1):48-53.D0I:10.1016/j.jvs.2009.01.011.
[60]颅脑疾病手术后抗癫痫药物应用的专家共识(试行)[J].中华神经外科杂志,2012,28(7):751-754.D0I:10.3760/cma.j.issn.1001-2346.2012.06.034.